La spettrometria di massa è un’importante tecnica che aiuta gli scienziati studiosi di proteomica a determinare la sequenza degli amminoacidi che costituiscono una proteina. In realtà, è adoperata anche in scientifica forense per definire la natura di un composto non noto rinvenuto presso la scena del crimine.
Sino al 1985 non fu possibile analizzare con questa tecnica la composizione delle proteine o degli acidi nucleici, in quanto il trattamento (il composto era vaporizzato per riscaldamento e, in seguito, bombardato mediante elettroni) che essi subivano negli spettrometri distruggeva le catene polimeriche. Tecniche più recenti quali la ionizzazione per elettronebulizzazione o elettronspray (ESI, ElectronSpray Ionization) hanno permesso di risolvere il problema.
La metodologia a elettronspray fu rivoluzionata da una serie di scienziati; il più importante contributore fu John B. Fenn, vincitore del Nobel per la chimica nel 2002; questi, insieme con M. Mann, C. K. Meng, S. F. Wong e C. M. Whitehouse pubblicò l’articolo “Electrospray ionization for mass spectrometry of large biomolecules” nel 1989.
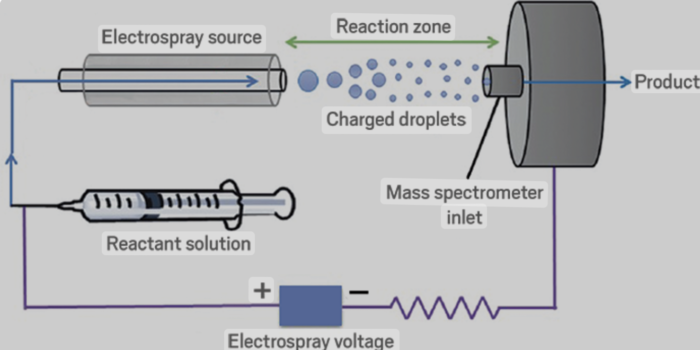
Con questa metodica una soluzione contenente una macromolecola, come una proteina o un filamento di DNA, viene vaporizzata in uno stretto tubicino capillare (la soluzione è introdotta nel capillare mediante ago ipodermico in acciaio inossidabile) tenuto ad alto voltaggio (da circa 3 a 5 kV) in modo da dare goccioline fini altamente cariche. Spinte dal campo elettrico, le goccioline migrano dall’estremità di ingresso del capillare di vetro a quella terminale. All’uscita del capillare si forma, quindi, una struttura a forma di cono detta “cono di Taylor”. La densità di carica sulla superficie delle goccioline aumenta fino a raggiungere il cosiddetto “limite di Rayleigh” al quale la repulsione di Coulomb (repulsione elettrostatica) diventa dello stesso ordine della tensione superficiale. L’instabilità risultante, a volte chiamata “esplosione di Coulomb”, lacera la gocciolina, producendo goccioline-figlie cariche che evaporano. Questa sequenza di eventi si ripete fino a quando il raggio di curvatura di una goccia-figlia diventa abbastanza piccolo che il campo, a causa della densità di carica superficiale, è sufficientemente forte da desorbire ioni dalla gocciolina nel gas ambiente. Gli ioni di desorbimento includono cationi (o anioni), a cui sono attaccati specie solventi o soluti che non sono ioni, producendo così i cosiddetti ioni “quasi-molecolari” adatti per l’analisi. A questo punto gli ioni sono convogliati nello spettrometro che misura i valori del rapporto fra massa e carica degli ioni con un’accuratezza dello 0,01%. Lo strumento ridà quindi un grafico, lo spettro di massa, nel quale la serie di picchi corrisponde a ioni che differiscono per una sola carica ionica e per la massa di un protone. Ottenuto questo spettro e determinando la carica degli ioni si potrà calcolare il valore della massa con un grado di precisione nettamente più alto rispetto a quello che si sarebbe raggiunto usando qualsivoglia altra tecnica.
Le prospettive future per la ionizzazione per elettronebulizzazione sono promettenti anche nel campo della medicina. Come riportato dal Percorso Diagnostico presentato durante il Congresso Nazionale AMCLI (Associazione Microbiologi CLinici Italiani) a Rimini, tenutosi tra il 18 e il 21 ottobre 2015, “le tecnologie emergenti per l’identificazione rapida di microrganismi palesano uno shift da algoritmi convenzionali verso metodi molecolari o spettrometrici”. Viene quindi citato il sistema PCR-ESI/MS (Polymerase Chain Reaction – ElectronSpray Ionization / Mass Spectrometry), capace di misurare, secondo il processo sopra accennato il rapporto fra la massa e la carica di frammenti di DNA o RNA, o meglio, ampliconi di PCR specie-specifici, generati da diversi loci su genomi di microrganismi. PCR-ESI/MS; può, quindi, misurare la massa (in realtà il rapporto massa/carica, da cui la massa) degli ampliconi con una precisione ben più che buona. Dacché si può calcolare la composizione di base dell’amplicone e, dal confronto con quella di organismi noti registrati in specifici database, si identifica il patogeno presente in circa fra le sei e le otto ore. In un altro articolo scientifico (“Preoperative metabolic classification of thyroid nodules using mass spectrometry imaging of fine-needle aspiration biopsies”) è spiegato come una tecnica variante dell’ESI, il desorbimento per ionizzazione elettrospray (DESI, Desorption ElectroSpray Ionization) potrebbe divenire un possibile metodo diagnostico per noduli tiroidei maligni. I test effettuati dai ricercatori (autori dell’articolo: DeHoog, Rachel J.; Zhang, Jialing; Alore, Elizabeth; Lin, John Q.; Yu, Wendong; Woody, Spencer; Almendariz, Christopher; Lin, Monica; Engelsman, Anton F.; Sidhu, Stan B.; Tibshirani, Robert; Suliburk, James; Eberlin, Livia S.) hanno infatti mostrato una sensibilità del 92% e specificità del 94% per i carcinomi papillari e 81% e 80% per adenomi follicolari normali e carcinomi follicolari maligni.
Michelangelo Grimaldi